§27. Генетическая связь между классами неорганических соединений
Вопрос в начале параграфа
✓ Происхождение химических веществ − это результат химических реакций. Какими взаимными превращениями генетически (от греч. genesis − происхождение, возникновение) связаны различные классы веществ?
Ответ:
Более полно многообразие генетических связей между классами неорганических соединений отражает схема 5: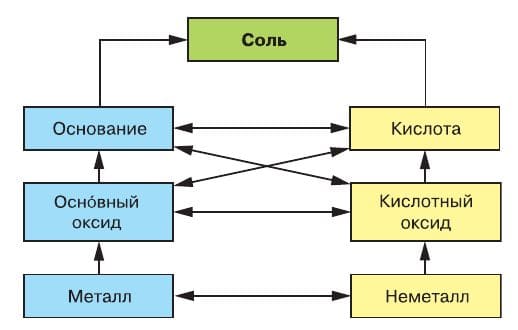
Схема 5
Например, осно́вный оксид можно получить реакцией металла с кислородом:
Mg + $O_{2}$ = MgO
Основание можно получить реакцией осно́вного оксида и воды:
MgO + $H_{2}$O = $Mg(OH)_{2}$
Вопрос (стр.118)
? Запишите уравнения реакций переходов. Возможно, вы сумеете предложить дополнительные связи или варианты переходов (их также отразите уравнениями реакций).
Cu → CuO → $CuSO_{4}$ → $Cu(OH)_{2}$ → CuO → Cu
Ответ:
Cu → CuO → $CuSO_{4}$ → $Cu(OH)_{2}$ → CuO → Cu
1) 2Cu + $O_{2}$ = 2CuO
2) CuO + $H_{2}$ $SO_{4}$ = $CuSO_{4}$ + $H_{2}$O
3) $CuSO_{4}$ + 2NaOH = $Cu(OH)_{2}$ + $Na_{2}$ $SO_{4}$
4) $Cu(OH)_{2}$ = CuO + $H_{2}$O
5) CuO + $H_{2}$ = Cu + $H_{2}$O
=Лабораторный опыт 27
1. С помощью тигельных щипцов или пинцета нагрейте на пламени спиртовки медную пластину или кусок толстой медной проволоки. Что наблюдаете? Образовавшийся чёрный налёт соскоблите на лист бумаги и пересыпьте в пробирку. Прилейте в неё 2 мл раствора серной кислоты и нагрейте содержимое с помощью держателя для пробирок. Что наблюдаете? К полученному раствору добавьте несколько капель раствора щёлочи. Что наблюдаете? Составьте соответствующие уравнения реакций.
Ответ:
При нагревании медной пластины образуется черный налет − оксид меди(II):
2Cu + $O_{2}$ = 2CuO
При взаимодействии оксида меди(II) с серной кислотой наблюдается растворение оксида и образование раствора голубого цвета:
CuO + $H_{2}$ $SO_{4}$ = $CuSO_{4}$ + $H_{2}$O
При добавлении к полученному раствору нескольких капель раствора щёлочи образуется осадок голубого цвета − гидроксид меди(II):
$CuSO_{4}$ + 2NaOH = $Na_{2}$ $SO_{4}$ + $Cu(OH)_{2}$
Проверьте свои знания
1. Как классифицируют простые вещества? Как классифицируют сложные вещества? Назовите признаки генетического ряда.
Ответ:
Простые вещества делятся на три класса: металлы, неметаллы, благородные газы.
Сложные вещества тоже делят на три класса: бинарные соединения, гидроксиды, соли.
Генетический ряд металла отражает взаимосвязь веществ разных классов, образованных одним и тем же химическим элементом − металлом.
Генетический ряд неметалла отражает взаимосвязь веществ разных классов, образованных одним и тем же химическим элементом − неметаллом.
Примените свои знания
2. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
S → X → $H_{2}$ $SO_{3}$ → $Na_{2}$ $SO_{3}$ → X
Ответ:
1) S + $O_{2}$ → $SO_{2}$
2) $SO_{2}$ + $H_{2}$O → $H_{2}$ $SO_{3}$
3) $H_{2}$ $SO_{3}$ + 2NaOH → $Na_{2}$ $SO_{3}$ + 2$H_{2}$O
4) $Na_{2}$ $SO_{3}$ → $SO_{2}$ + $Na_{2}$O
X = $SO_{2}$ − единственное решение.
3. В схеме превращений
$SO_{2}$ $\overset{X_{1}}{→}$ $SO_{3}$ $\overset{X_{2}}{→}$ $H_{2}$ $SO_{4}$ $\overset{X_{3}}{→}$ $Na_{2}$ $SO_{4}$
веществами $X_{1}$, $X_{2}$ и $X_{3}$ являются соответственно:
1) $O_{2}$, $H_{2}$O, NaOH
2) $NO_{2}$, $H_{2}$, NaCl
3) $O_{2}$, $H_{2}$O, $N_{2}$
4) $O_{2}$, $H_{2}$, $NH_{3}$ * $H_{2}$O
Запишите уравнения реакций, соответствующих приведённой цепочке превращений.
Ответ:
Ответ: 1) $X_{1}$ = $O_{2}$, $X_{2}$ = $H_{2}$O, $X_{3}$ = NaOH.
Запишем уравнения реакций:
1) 2$SO_{2}$ + $O_{2}$ = 2$SO_{3}$
2) $SO_{3}$ + $H_{2}$O = $H_{2}$ $SO_{4}$
3) $H_{2}$ $SO_{4}$ + 2NaOH = $Na_{2}$ $SO_{4}$ + 2$H_{2}$O
4. В цепочке превращений
Ca → $X_{1}$ → $Ca(OH)_ {2}$ → $X_{2}$ → CaO → $X_{3}$ → AgCl
веществами $X_{1}$, $X_{2}$ и $X_{3}$ являются соответственно:
1) CaO, $CaCO_{3}$, $CaCl_{2}$
2) $CaSO_{4}$, $CaCO_{3}$, $CaCl_{2}$
3) CaO, $CaSO_{4}$, $CaCl_{2}$
4) CaO, $Ca(HCO_{3}$ $)_{2}$, $CaCO_{3}$
Запишите уравнения реакций, соответствующих приведённой цепочке превращений
Ответ:
Ответ: 1) $X_{1}$ = CaO, $X_{2}$ = $CaCO_{3}$, $X_{3}$ = $CaCl_{2}$
Запишем уравнения реакций:
1. 2Ca + $O_{2}$ = 2CaO
2. CaO + $H_{2}$O = $Ca(OH)_{2}$
3. $Ca(OH)_{2}$ + $K_{2}$ $CO_{3}$ = $CaCO_{3}$ + 2KOH
4. $CaCO_{3}$ = CaO + $CO_{2}$
5. CaO + 2HCl = $CaCl_{2}$ + $H_{2}$O
6. $CaCl_{2}$ + 2$AgNO_{3}$ = 2AgCl + $Ca(NO_{3}$ $)_{2}$
5. Найдите массу осадка, который выпадает при сливании 807 г 20 %−ного раствора нитрата свинца(II) с раствором, содержащим избыток иодида калия.
Ответ:
Дано:
$m_{р-ра}$ ($Pb(NO_{3}$ $)_ {2}$) = 807 г
ω = 20%
Найти:
$m_{(осадка)}$ − ?
Решение:
$Pb(NO_{3}$ $)_ {2}$ + 2KI = $PbI_{2}$↓ + 2$KNO_{3}$
m($Pb(NO_{3}$ $)_ {2}$) = $m_{р-ра}$ ($Pb(NO_{3}$ $)_ {2}$) * ω
m($Pb(NO_{3}$ $)_ {2}$) = 807г * 0,2 = 161 г
n($Pb(NO_{3}$ $)_ {2}$) = m : M = 161 г : 331 г/моль = 0,49 моль
n($PbI_{2}$) = n($Pb(NO_{3}$ $)_ {2}$) = 0,49 моль
m($PbI_{2}$) = n * M = 0,49 моль * 461 г/моль = 224,8 г
Ответ: масса осадка − 224,8 г.
6. Какие из перечисленных веществ взаимодействуют с соляной кислотой: магний, оксид меди(II), гидроксид меди(II), медь, нитрат магния, гидроксид железа(III), оксид кремния(IV), нитрат серебра, сульфид железа(II)? Запишите уравнения возможных реакций.
Ответ:
С соляной кислотой взаимодействуют:
1) магний,
2) оксид меди(II),
3) гидроксид меди(II),
4) гидроксид железа(III),
5) нитрат серебра,
6) сульфид железа(II).
Уравнения реакций:
1) 2HCl + Mg = $MgCl_{2}$ + $H_{2}$
2) 2HCl + CuO = $CuCl_{2}$ + $H_{2}$O
3) 2HCl + $Cu(OH)_{2}$ = $CuCl_{2}$ + 2$H_{2}$O
4) HCl + $AgNO_{3}$ = AgCl + $HNO_{3}$
5) 2HCl + FeS = $FeCl_{2}$ + $H_{2}$S
6) 3HCl + $Fe(OH)_{3}$ = $FeCl_{3}$ + 3$H_{2}$O
7. Какие из перечисленных веществ взаимодействуют с гидроксидом натрия: оксид углерода(IV), гидроксид кальция, оксид меди(II), нитрат меди(II), хлорид аммония, кремниевая кислота, сульфат калия? Запишите уравнения возможных реакций, назовите продукты реакций.
Ответ:
С гидроксидом натрия взаимодействуют:
1) оксид углерода(IV),
2) нитрат меди(II),
3) хлорид аммония,
4) кремниевая кислота.
Уравнения реакций:
1) 2NaOH + $CO_{2}$ = $Na_{2}$ $CO_{3}$ + $H_{2}$O
2) 2NaOH + $Cu(NO_{3}$ $)_{2}$ = $Cu(OH)_{2}$ + 2$NaNO_{3}$
3) NaOH + $NH_{4}$Cl = NaCl + $NH_{3}$ + $H_{2}$O
4) 2NaOH + $H_{2}$ $SiO_{3}$ = $Na_{2}$ $SiO_{3}$ + 2$H_{2}$O
Используйте дополнительную информацию
8. Предложите свою классификацию химических веществ и генетической связи между классами неорганических соединений.
Ответ:
Простые вещества можно классифицировать на металлы и неметаллы, сложные вещества на бинарные соединения, гидроксиды и соли.
Генетическая связь между классами неорганических соединений:
Практическая работа 7
Вопрос в начале работы
✓ Какие задачи можно решать с помощью химического эксперимента?
Ответ:
С помощью химического эксперимента можно решать экспериментальные химические задачи.
Реакция нейтрализации
1. Реакция нейтрализации. С помощью выданных растворов−реактивов (гидроксид натрия, серная кислота, азотная кислота, сульфат меди(II), фенолфталеин) проведите четыре возможные реакции нейтрализации. Запишите уравнения реакций.
Ответ:
Дано: NaOH, $H_{2}$ $SO_{4}$, $HNO_{3}$, $CuSO_{4}$, фенолфталеин.
Запишем уравнения реакций:
1) 2NaOH + $H_{2}$ $SO_{4}$ = $Na_{2}$ $SO_{4}$ + 2$H_{2}$O
2) NaOH + $HNO_{3}$ = $NaNO_{3}$ + $H_{2}$O
3) Получим гидроксид меди(II):
2NaOH + $CuSO_{4}$ = $Cu(OH)_{2}$ + $Na_{2}$ $SO_{4}$
4) Имея гидроксид меди(II), запишем еще 2 реакции нейтрализации:
$Cu(OH)_{2}$ + $H_{2}$ $SO_{4}$ = $CuSO_{4}$ + 2$H_{2}$O
$Cu(OH)_{2}$ + 2$HNO_{3}$ = $Cu(NO_{3}$ $)_{2}$ + 2$H_{2}$O
Получение соединений
2. Получение соединений. С помощью выданных растворов−реактивов (гидроксид натрия, хлорид бария, сульфат меди (II), соляная кислота) и твёрдых веществ (железо, карбонат натрия) получите четыре соли, щёлочь и нерастворимое основание, одну кислоту и один металл. Запишите уравнения реакций.
Ответ:
Дано: NaOH, $BaCl_{2}$, $CuSO_{4}$, HCl, Fe, $Na_{2}$ $CO_{3}$,
• Запишем уравнения реакций получения 4 солей:
1) $BaCl_{2}$ + $Na_{2}$ $CO_{3}$ = $BaCO_{3}$ + 2NaCl
$BaCO_{3}$ − соль
NaCl − соль
2) $BaCl_{2}$ + $CuSO_{4}$ = $BaSO_{4}$ + $CuCl_{2}$
$BaSO_{4}$ − соль
$CuCl_{2}$ − соль
• Запишем уравнение реакции получения нерастворимого основания:
$CuSO_{4}$ + 2NaOH = $Cu(OH)_{2}$ + $Na_{2}$ $SO_{4}$
• Запишем уравнение реакции получения металла:
$CuSO_{4}$ + Fe = $FeSO_{4}$ + Cu
• Запишем уравнение реакции получения кислоты:
$Na_{2}$ $CO_{3}$ + 2HCl = 2NaCl + $H_{2}$ $CO_{3}$ (угольная кислота нестабильная, поэтому сразу распадется на углекислый газ и воду)
• Запишем уравнение реакции получения щелочи:
NaOH + $BaCl_{2}$ = реакция не идет, так как не образуется осадок или газ, следовательно, щелочь получить нельзя.
Идентификация кислоты
3. Идентификация кислоты. Используя необходимые реактивы, проведите реакции, подтверждающие качественный состав серной кислоты. Запишите уравнения реакций.
Ответ:
Кислую среду мы можем подтвердить с помощью индикатора лакмуса. При добавлении индикатора раствор приобретает красную окраску.
$H_{2}$ $SO_{4}$ = 2$H^{+}$ + $SO_{4}^{2-}$
Качественной реакцией на анион $SO_{4}^{2-}$ является реакция с гидроксидом бария, образуется осадок белого цвета − сульфат бария.
$H_{2}$ $SO_{4}$ + $Ba(OH)_{2}$ = $BaSO_{4}$ + 2$H_{2}$O
Идентификация основания
4. Идентификация основания. Используя необходимые реактивы, проведите реакции, подтверждающие качественный состав гидроксида кальция, выданного вам в виде известковой воды. Запишите уравнения проведённых реакций.
Ответ:
Щелочную среду мы можем подтвердить с помощью индикатора фенолфталеина. При добавлении индикатора раствор приобретает малиновую окраску.
$Ca(OH)_{2}$ = $Ca^{2+}$ + 2$OH^{-}$
Качественной реакцией на катион $Ca^{2+}$ является реакция с карбонатом, так как образуется осадок белого цвета − карбонат.
$Ca(OH)_{2}$ + $Na_{2}$ $CO_{3}$ = $CaCO_{3}$ + 2NaOH
Идентификация солей
5. Идентификация солей. Используя необходимые реактивы, проведите реакции, подтверждающие качественный состав: а) хлорида бария; б) сульфата аммония. Запишите уравнения реакций.
Ответ:
а) Качественная реакция на хлорид ион − реакция с нитратом серебра.
$BaCl_{2}$ + 2$AgNO_{3}$ = $Ba(NO_{3}$ $)_{2}$ + 2AgCl
В результате реакции образуется белый творожистый осадок − хлорид серебра.
б) Качественная реакция на сульфат ион − реакция с гидроксидом бария.
$(NH_{4}$ $)_{2}$ $SO_{4}$ + $Ba(OH)_{2}$ = $BaSO_{4}$ + 2$NH_{3}$ + 2$H_{2}$O
В результате реакции образуется белый осадок − сульфат бария.

