§37. Металлическая химическая связь
Вопрос в начале параграфа
✓ Какова природа химической связи, удерживающей атомы металла в металлическом изделии или слитке?
Ответ:
В металлическом изделии существуют особые взаимопревращающиеся частицы, которые называют ион−атомами. Эти частицы и связываются между собой обобществлёнными электронами в единое целое.
Лабораторный опыт 29
1. Создайте модель, иллюстрирующую особенности металлической связи. Для этого на одно небольшое зеркало (или стеклянную пластину) поместите 2—3 капли воды. На это зеркало положите сверху другое зеркало и подвигайте их относительно друг друга. Тонкий слой воды играет роль обобществлённых электронов и позволяет иллюстрировать такое свойство металлов, как пластичность (зеркала легко смещаются, но оторвать их друг от друга непросто).
Ответ:
Мы создали модель, иллюстрирующую особенности металлической связи. Для этого на одно небольшое зеркало (или стеклянную пластину) поместили 2—3 капли воды. На это зеркало положили сверху другое зеркало и подвигали их относительно друг друга. Тонкий слой воды играет роль обобществлённых электронов и позволяет иллюстрировать такое свойство металлов, как пластичность (зеркала легко смещаются, но оторвать их друг от друга непросто).
Вывод: этот эксперимент показывает такое свойство металлов, как пластичность.
Проверьте свои знания
1. Что общего между ковалентной и металлической связями и чем они различаются?
Ответ:
Все химические связи: ионная, ковалентная (полярная и неполярная), металлическая — имеют сходную физическую природу. О единстве связей говорит тот факт, что между ними нет резкой границы: ионную связь можно рассматривать как крайний случай ковалентной полярной связи. Металлы при высоких температурах переходят в жидкое состояние — плавятся, а при дальнейшем повышении температуры испаряются. В парообразном состоянии атомы металлов состоят из отдельных молекул — одно− или двухатомных. В последнем случае их атомы связаны ковалентной связью.
В ковалентной связи нет ионов, и общие ковалентные пары могут быть смещены в сторону более электроотрицательных элементов, если связь образована разными неметаллами. Вещества с ковалентными связями образуют атомные или молекулярные кристаллические решетки, а вещества с металлическими связями образуют металлические кристаллические решетки.
2. Что общего между ионной и металлической связями и чем они различаются?
Ответ:
И ионная, и металлическая типы связей образуются за счет образования ионов.
Ионная связь образуется между ионами за счёт электростатического притяжения. Ионная связь возникает при взаимодействии атомов, имеющих ярко выраженные противоположные свойства: между элементами−металлами IA− и IIA−групп и элементами−неметаллами VIIA−группы, кислородом и азотом.
В образовании металлической связи принимают участия металлы. Атомы большинства элементов−металлов содержат на внешнем энергетическом уровне 1−3 электрона и (или) имеют больший радиус атома по сравнению с атомами элементов−неметаллов. Легко отрываясь от атомов металлов, внешние электроны становятся общими для всего металлического изделия или слитка. Атомы при этом превращаются в положительные ионы, расположенные в узлах металлической кристаллической решётки. Свободно передвигаясь между ними, обобществлённые электроны вновь соединяются с ионами, превращая их в атомы, затем опять отрываются от этих атомов, превращая их в ионы и т. д.
3. Определите тип химической связи в веществах: а) Ca; б) $CaCl_{2}$; в) $Cl_{2}$; г) HCl.
Ответ:
а) Ca − металлическая связь
б) $CaCl_{2}$ − ионная связь
в) $Cl_{2}$ − ковалентная неполярная связь
г) HCl − ковалентная полярная связь
4. Выразите своё отношение к утверждению о том, что все типы химической связи имеют единую физическую природу.
Ответ:
Все химические связи: ионная, ковалентная (полярная и неполярная), металлическая − имеют сходную физическую природу. О единстве связей говорит тот факт, что между ними нет резкой границы: ионную связь можно рассматривать как крайний случай ковалентной полярной связи. Металлы при высоких температурах переходят в жидкое состояние − плавятся, а при дальнейшем повышении температуры испаряются. В парообразном состоянии атомы металлов состоят из отдельных молекул − одно− или двухатомных. В последнем случае их атомы связаны ковалентной связью
=Примените свои знания
5. Запишите формулы и укажите вид химической связи для следующих веществ: а) поваренная соль; б) серебро; в) магний; г) углекислый газ; д) вода; е) азот.
Ответ:
а) поваренная соль (NaCl) − ионная связь
б) серебро (Ag) − металлическая связь
в) магний (Mg) − металлическая связь
г) углекислый газ ($CO_{2}$) − ковалентная полярная связь
д) вода ($H_{2}$O) − ковалентная полярная связь
е) азот ($N_{2}$) − ковалентная неполярная связь
6. Запишите по одной схеме образование ионной, ковалентной полярной и неполярной, металлической связей для веществ, перечисленных в предыдущем задании.
Ответ:
Схема образования ионной связи: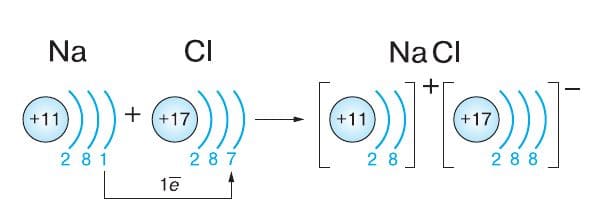
Схема образования ковалентной полярной связи: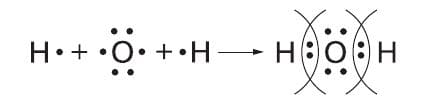
Схема образования ковалентной неполярной связи: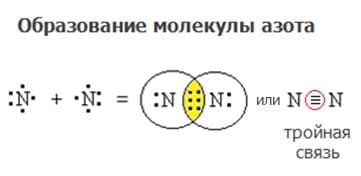
Схема образования металлической связи:
$Mg^{0}$ − 2 e = $Mg^{2+}$
$Ag^{0}$ − 1 e = $Ag^{1+}$
7. Какое количество вещества соответствует 96 кг меди?
Ответ:
Дано:
m (Cu) = 96 кг
Найти:
n (Cu) − ?
Решение:
96 кг = 96000 г
n (Cu) = m : M = 96000 г : 64 г/моль = 1500 моль
Ответ: n (Cu) = 1500 моль.
Используйте дополнительную информацию
8. Как строение металлов связано с их физическими свойствами? Назовите области применения металлов, в которых используют их физические свойства.
Ответ:
Ионы металла упакованы в плотные кристаллические структуры — металлические кристаллические решётки. В кристаллической решётке натрия, например, каждый атом металла окружён восемью другими. Образуется гигантский металлический кристалл, связанный особым «клеем» — обобществлёнными электронами (рис. 77, 78). Эти обобществлённые электроны и определяют наиболее характерные физические свойства металлов: все металлы твёрдые, за исключением ртути, проводят электрический ток и теплоту, куются, прокатываются, вытягиваются в проволоку, имеют металлический блеск.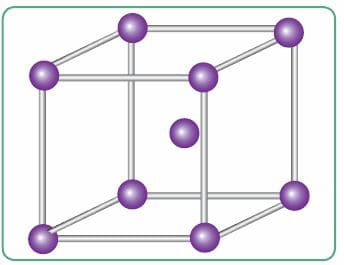
Рис. 77. Модель строения фрагмента кристаллического натрия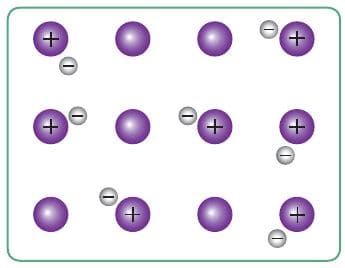
Рис. 78. Схема металлической связи кристаллического натрия
Такое свойство металлов, как электропроводность, обуславливает их применение при производстве проводников. Теплопроводность дает возможность использовать их в производстве нагревательных элементов. Металлы обладают металлическим блеском, поэтому из них делают украшения. А твердость и прочность металлов необходима при изготовлении оружия, инструментов и строительных конструкций.

