§31. Строение электронных оболочек атомов
Вопрос в начале параграфа
✓ Как располагаются электроны вокруг атомного ядра? Хаотически или в определённом порядке?
Ответ:
Электрон рассматривается в современной науке как «размазанное» в пространстве вокруг ядра электронное облако. Следовательно, нельзя говорить о точном нахождении электрона в пространстве в некоторый момент времени — его положение всегда определено, с той или иной долей вероятности. То есть вокруг атомного ядра электроны располагаются хаотически.
Проверьте свои знания
1. Дайте определения электронной оболочке атома и энергетическому уровню (электронному слою).
Ответ:
Электронная оболочка – это совокупность электронов в пространстве вокруг ядра атома.
Близкие по запасу энергии электроны образуют электронные слои, или энергетические уровни.
2. Каков порядок заполнения электронных слоёв у атомов № 1—20 в таблице Д. И. Менделеева?
Ответ:
Рассмотрим строение электронных оболочек атомов элементов № 1−20. У атомов элементов первого периода − водорода и гелия − один энергетический уровень. Единственный электрон атома водорода компенсирует положительный заряд ядра, равный +1.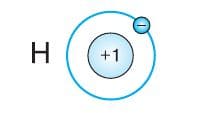
Заряд ядра атома гелия на единицу больше, в его электронной оболочке добавляется один электрон. Внешний (первый и единственный) энергетический уровень завершён: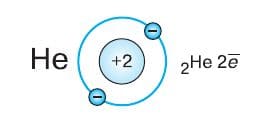
Пара электронов делает атом гелия очень устойчивым. Недаром этот благородный газ по−прежнему можно назвать инертным: до сих пор не получено ни одного соединения гелия. У атомов элементов второго периода появляется второй энергетический уровень. По мере увеличения заряда атомного ядра при переходе от элемента к элементу внешний энергетический уровень последовательно начинает заполняться электронами. При этом внутренний (первый) уровень остаётся заполненным. У атома лития на внешнем энергетическом уровне расположен один электрон, у атома бериллия − два и т. д.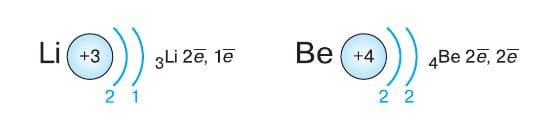
Завершают второй период фтор, атом которого содержит семь электронов на втором (внешнем) уровне, и неон, у атома которого электронная оболочка завершена до устойчивого восьмиэлектронного состояния: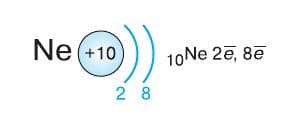
Электронные оболочки атомов элементов третьего периода, который завершает аргон, застраиваются аналогично тому, как это происходит во втором периоде: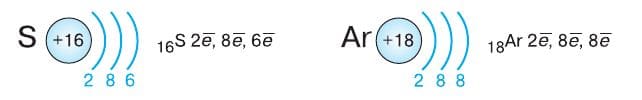
В электронной оболочке атомов элементов четвёртого периода появляется, соответственно, четвёртый энергетический уровень, на котором у атома калия располагается один электрон, а у атома кальция − два.
Примените свои знания
3. Укажите общее число электронов и число энергетических уровней в атомах элементов следующих групп: а) щелочных металлов; б) щёлочноземельных металлов; в) галогенов; г) благородных газов.
Ответ:
а) Щелочные металлы:
Металл Общее число электронов Число энергетических уровней
Натрий 3 2
Литий 11 3
Калий 19 4
Рубидиц 37 5
Цезий 55 6
б) Щелочноземельные металлы:
Металл Общее число электронов Число энергетических уровней
Берилий 4 2
Магний 12 3
Кальций 20 4
Стронций 38 5
Барий 56 6
в) Галогены:
Галоген Общее число электронов Число энергетических уровней
Фтор 9 2
Хлор 17 3
Бром 35 4
Йод 53 5
Астат 85 6
г) Благородные газы:
Газ Общее число электронов Число энергетических уровней
Гелий 2 1
Неон 10 2
Аргон 18 3
Криптон 36 4
Ксенон 54 5
Радон 86 6
4. Запишите распределение электронов по энергетическим уровням в атомах следующих элементов: а) магний; б) кальций; в) алюминий; г) фосфор; д) хлор.
Ответ:
а) Распределение электронов по энергетическим уровням в атоме магния:
Mg +12 $\underset{2e}{)}$ $\underset{8e}{)}$ $\underset{2e}{)}$
б) Распределение электронов по энергетическим уровням в атоме кальция:
Ca +20 $\underset{2e}{)}$ $\underset{8e}{)}$ $\underset{8e}{)}$ $\underset{2e}{)}$
в) Распределение электронов по энергетическим уровням в атоме алюминия:
Al +13 $\underset{2e}{)}$ $\underset{8e}{)}$ $\underset{3e}{)}$
г) Распределение электронов по энергетическим уровням в атоме фосфора:
P+15 $\underset{2e}{)}$ $\underset{8e}{)}$ $\underset{5e}{)}$
д) Распределение электронов по энергетическим уровням в атоме хлора:
Cl +17 $\underset{2e}{)}$ $\underset{8e}{)}$ $\underset{7e}{)}$
5. Назовите химические элементы, расположение электронов по энергетическим уровням которых соответствует ряду чисел: а) 2, 1; б) 2, 8, 1; в) 2, 8, 7; г) 2, 8, 8, 2.
Ответ:
Для определения химического элемента найдем общее количество электронов, оно равняется порядковому номеру элемента.
а) 2 + 1 = 3, следовательно, элемент − литий (Li).
б) 2 + 8 + 1 = 11, следовательно, элемент − натрий (Na).
в) 2 + 8 + 7 = 17, следовательно, элемент − хлор (Cl).
г) 2 + 8 + 8 + 2 = 20, следовательно, элемент − кальций (Ca).
6. Какие из наборов чисел и почему не могут соответствовать распределению электронов по энергетическим уровням атома химического элемента: а) 2, 7, 1; б) 2, 3; в) 1, 8, 1; г) 3, 2; д) 2, 9; е) 2, 7; ж) 2, 8, 8?
Ответ:
а) 2, 7, 1 – конфигурация не может соответствовать распределению электронов по энергетическим уровням атома химического элемента, т.к. 3−ий уровень заполняется только после полного заполнения 2−ого уровня.
в) 1, 8, 1 – конфигурация не может соответствовать распределению электронов по энергетическим уровням атома химического элемента, т.к. на 1−ом уровне 1 электрон только у атома водорода.
г) 3, 2 – конфигурация не может соответствовать распределению электронов по энергетическим уровням атома химического элемента, так как максимальное количество электронов на 1−ом уровне равняется 2.
д) 2, 9 – конфигурация , не может соответствовать распределению электронов по энергетическим уровням атома химического элемента, так как максимальное количество электронов на 2−ом уровне равняется 8.
Наборы чисел б, е, ж могут соответствовать распределению электронов по энергетическим уровням атома химического элемента.
7. Замените «X» соответствующим символом или цифрой: а) $_ {10}X$ 2, 8; б) $_ {X}$P 2, X, 5; в) $_ {2}$He X; г) $_{X}$X X, X, 2.
Ответ:
а) Количество электронов численно равно порядковому номеру, значит порядковый номер равняет 10, следовательно, это гелий (He).
б) У фосфора 15 электронов, значит х = 15 − 2 − 5 = 8.
в) У гелия 2 электрона, значит X = 2.
г) 2 электрона на внешнем энергетическом уровне, значит IIA−группа. 3 энергетических уровня, значит, это магний Mg. Следовательно, $_{12}Mg$ 2, 8, 2.
8. Атом гелия содержит на внешнем энергетическом уровне два электрона, подобно атомам бериллия и магния. Почему гелий помещён в периодической системе Д. И. Менделеева в VIIIA−группу, а не в IIA−группу?
Ответ:
Гелий – типичный благородный газ и расположен в VIIIА−группе. У атомов магния и бериллия внешний уровень заполнен не полностью, гелий же имеет устойчивую конфигурацию, характерную для всех благородных газов, поэтому он располагается в VIIIA−группу, а не в IIA−группу.
9. Запишите распределение электронов по энергетическим уровням атома железа, зная, что третий энергетический уровень его не завершён, а на внешнем уровне содержится 2 электрона.
Ответ:
Запишем распределение электронов по энергетическим уровням атома железа:
Fe +26 $\underset{2e}{)}$ $\underset{8e}{)}$ $\underset{14e}{)}$ $\underset{2e}{)}$
10. Запишите распределение электронов по энергетическим уровням иона, в который превращается атом кислорода, принявший два электрона. Как называют внешний слой иона кислорода?
Ответ:
Запишем распределение электронов по энергетическим уровням иона кислорода:
O +10 $\underset{2e}{)}$ $\underset{8e}{)}$
Внешний энергетический уровень иона кислорода называется завершенным, так как на нем 8 электронов.
11. Запишите распределение электронов по энергетическим уровням иона, в который превращается атом кальция, отдавший два электрона. Как называются внешние слои атома и иона кальция? Каков порядковый номер у этих слоёв?
Ответ:
• Запишем распределение электронов по энергетическим уровням атома кальция:
Ca +20 $\underset{2e}{)}$ $\underset{8e}{)}$ $\underset{8e}{)}$ $\underset{2e}{)}$
Внешний слой (4−ый слой) атома кальция называется незавершенный.
• Запишем распределение электронов по энергетическим уровням иона кальция:
$Ca^{2+}$ $\underset{2e}{)}$ $\underset{8e}{)}$ $\underset{8e}{)}$
Внешний слой (3−ий слой) иона кальция называется завершенный.
Используйте дополнительную информацию
12. Предложите вариант графического отображения памятки о порядке заполнения электронных слоёв у атомов № 1−20 в таблице Д. И. Менделеева.
Ответ:
Вариант графического отображения памятки о порядке заполнения электронных слоёв у атомов № 1−20 в таблице Д. И. Менделеева:
2 ⟶ 8 ⟶ 8 ⟶ 2
У атомов №1−20 энергеические уровни заполняются последовательно до максимальных значений.

