§30. Основные сведения о строении атома
Вопрос в начале параграфа
✓ В переводе с греческого «атом» означает «неделимый». Соответствует ли это действительности?
Ответ:
Да, это соответствует действительности. Атом — это наименьшая электронейтральная частица химического элемента, состоящая из ядра и электронной оболочки.
Проверьте свои знания
1. Какие элементарные частицы составляют ядро атома? Как определить заряд ядра атома, количество протонов в ядре, количество нейтронов, массовое число элемента?
Ответ:
Ядро атома образовано элементарными частицами двух видов: протонами и нейтронами.
Заряд ядра атома численно равен количеству протонов.
Число протонов в ядре равно числу электронов в электронной оболочке.
Количество нейтронов можно рассчитать по формуле: массовое число − количество протонов.
Масса ядра атома численно равна сумме протонов и нейтронов. Эту величину называют массовым числом атома.
2. Сравните между собой элементарные частицы, т. е. найдите общее и различия между протоном и нейтроном, протоном и электроном.
Ответ:
Сравним между собой элементарные частицы.
Протон:
1) Масса: 1,67 * $10^{-27}$ кг.
2) Заряд: +1.
3) Число протонов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева
Нейтрон:
1) Масса: 1,67 * $10^{-27}$ кг.
2) Заряд: 0.
3) Число нейтронов в атоме находят по формуле N = A – Z, где A − это массовое число, Z − количество протонов.
Электрон:
1) Масса: 9,11 * $10^{-31}$ кг.
2) Заряд: −1.
3) Число электронов в атоме соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева.
3. Что называют изотопами? Запишите обозначения изотопов водорода, хлора и калия.
Ответ:
Атомы одного химического элемента, содержащие различное число нейтронов в ядре и, следовательно, имеющие различные массовые числа, называются изотопами.
$^{35}_{17}$Cl, $^{37}_{17}$Cl − обозначение изотопов хлора.
$^{1}_{1}$H, $^{2}_{1}$H, $^{3}_ {1}$H − обозначение изотопов водорода.
$^{39}_ {19}$K, $^{40}_{19}$K − обозначение изотопов калия.
Примените свои знания
4. Рассчитайте число нейтронов в ядрах атомов: $^{15}$N, $^{19}$F, $^{27}$Al, $^{37}$Cl, $^{108}$Ag.
Ответ:
Посчитаем количество нейтронов по формуле: A = Z + N, где Z − массовое число, N − количество протонов.
Значение N и Z можно узнать по таблице Д. И. Менделеева.
$^{15}$N: 15 − 7 = 8
$^{19}$F: 19 − 9 = 10
$^{27}$Al: 27 − 13 = 14
$^{37}$Cl: 37 − 17 = 20
$^{108}$Ag: 108 − 47 = 61
5. Вместо символа «X» запишите соответствующее число или символ химического элемента: $^{24}_{X}$Mg, $^{52}_{24}$X, $_{X}$K, $_{14}$X.
Ответ:
$^{24}_ {X}$Mg: X − это количество протонов, или порядковый номер, это значение можно узнать по таблице Менделеева.
Ответ: X = 12.
$^{52}_ {24}$X: нам известно массовое число и количество протонов, то есть порядковый номер элемента, элемент можем узнать по таблице Менделеева.
Ответ: X − хром (Cr).
$_ {X}$K: X − это количество протонов, или порядковый номер, это значение можно узнать по таблице Менделеева.
Ответ: X = 19.
$_{14}$X: нам известно количество протонов, то есть порядковый номер элемента, элемент можем узнать по таблице Менделеева.
Ответ: X − кремний (Si).
6. Определите, сколько различных молекул хлороводорода можно составить из природного изотопа водорода
$^{1}_ {1}$H и двух природных изотопов хлора − $^{35}_ {17}$Cl и $^{37}_{17}$Cl. Рассчитайте их относительные молекулярные массы.
Ответ:
Дано:
$^{1}_ {1}$H,
$^{35}_{17}$Cl,
$^{37}_{17}$Cl
Найти:
Mr − ?
Решение:
$^{1}_ {1}$H + $^{35}_{17}$Cl = HCl
Mr = 1 + 35 = 36
$^{1}_{1}$H + $^{37}_{17}$Cl = HCl
Mr = 1 + 37 = 38
Ответ: можно составить 2 молекулы хлороводорода.
7. Относительная атомная масса брома, приведённая в таблице Д. И. Менделеева, равна 80. Однако изотопа с таким массовым числом не существует. В природе бром представлен изотопами $^{79}$Br и $^{81}$Br. Рассчитайте число нейтронов в ядрах этих изотопов.
Ответ:
Рассчитаем число нейтронов в ядрах этих изотопов по формуле: N = A − Z, где A − массовое число; Z − количество протонов.
По таблице Менделеева узнаем, что Z = 35.
$^{79}$Br: 79 − 35 = 44
$^{81}$Br: 81 − 35 = 46
8. Определите количество протонов, нейтронов и электронов в атомах следующих изотопов: а) $^{34}_{16}S$; б) $^{11}_{5}B$; в) $^{13}_{6}C$; г) $^{79}_{35}Br$; д) $^{3}_{1}H$
Ответ:
а) Количество нейтронов рассчитывается по формуле: N = A − Z, где N − количество нейтронов, A − массовое число; Z − количество протонов.
Количество протонов равняется количеству электронов и порядковому номеру.
$^{34}_{16}S$
N = 34 − 16 = 18
Z = e = 16
б) Количество нейтронов рассчитывается по формуле: N = A − Z, где N − количество нейтронов, A − массовое число; Z − количество протонов.
Количество протонов равняется количеству электронов и порядковому номеру.
$^{11}_{5}B$
N = 11 − 5 = 6
Z = e = 5
в) Количество нейтронов рассчитывается по формуле: N = A − Z, где N − количество нейтронов, A − массовое число; Z − количество протонов.
Количество протонов равняется количеству электронов и порядковому номеру.
$^{13}_{6}C$
N = 13 − 6 = 7
Z = e = 6
г) Количество нейтронов рассчитывается по формуле: N = A − Z, где N − количество нейтронов, A − массовое число; Z − количество протонов.
Количество протонов равняется количеству электронов и порядковому номеру.
$^{79}_{35}Br$
N = 79 − 35 = 44
Z = e = 35
д) Количество нейтронов рассчитывается по формуле: N = A − Z, где N − количество нейтронов, A − массовое число; Z − количество протонов.
Количество протонов равняется количеству электронов и порядковому номеру.
$^{3}_{1}H$
N = 3 − 1 = 2
Z = e = 1
Используйте дополнительную информацию
9. Подготовьте сообщение и презентацию на тему «Эволюция представлений о сложном строении атома».
Ответ:
Эволюция представлений о сложном строении атома
Модели атомов:
1) Кусочки материи − Демокрит полагал, что свойства того или иного вещества определяются формой, массой и другими характеристиками образующих его атомов.
2) Модель атома Томпсона (модель «Пудинг с изюмом»). Томпсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами.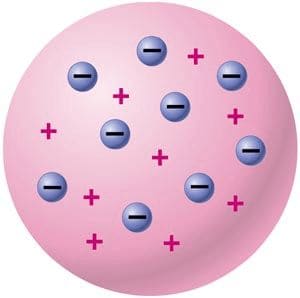
3) Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн: вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца.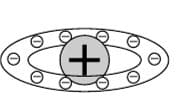
4) Планетарная модель атома Бора−Резерфорда. В 1911 году Эрнест Резерфорд пришёл к выводу, что атом представляет собой подобие планетарной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора−Резерфорда»).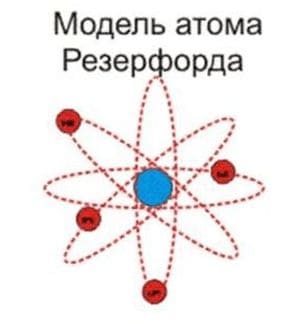
5) Квантово−механическая модель атома. Ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько−нибудь определённым траекториям (неопределенность координаты электрона в атоме может быть сравнима с размерами самого атома).

